제약회사 QC를 품질관리, QA를 품질보증이라고 하며, 두 직무를 합쳐 품질 직무라고 합니다. 일반적으로 제약회사 품질 직무 채용은 QC 부서의 빈도가 더 큽니다. QA는 실무 경험자 또는 석사 출신의 졸업생을 뽑는 경우도 있습니다. 제약회사 QC 및 QA 취업을 목표로 하는 취준생들을 위해 제약회사 QC, QA 부서에서 하는 일을 정리했습니다.
실제로 직무에 대한 이해 없이 막연히 지원하고 계시다면 아래 내용을 숙지해 제약회사 품질 직무의 업무를 정확히 이해하시기 바랍니다. QC는 Quality Control, QA는 Quality Assuarance 인데, 일반적으로는 실험실에서 실험복(랩코트)을 입고 분석 기기를 다루고 있는 모습은 QC, 문서 서류 꾸러미 옆에서 문서 확인을 하거나 서명하는 모습은 QA 로 인식하고 있습니다.
이는 품질 직무에 지원하는 대부분의 신입 지원자분들이 이해하고 있는 수준으로 이것만 가지고 품질 직무에 채용을 지원을 하고 있다면 분명 서합에 어려움을 겪으실 겁니다. 다른 지원자가 알고 있는 수준 이상으로 직무에 대한 파악과 지식을 갖춘 지원자로 어필하기 위해 각각의 부서가 더 구체적으로는 어떤 일을 하는 부서인지 확인하기 바랍니다.
목차
제약회사 QC 하는 일
제약회사 QC 는 제품에 사용되는 원료 및 자재부터 최종 제품까지 전 과정의 제품의 품질을 확인하고, 기준 내 제품이 출하 되도록 품질을 관리하는 부서입니다. 원자재 또는 제품의 품질이 만족스럽다고 판정되기 이전에 제조에 사용되거나 판매 또는 공급용으로 출하되지 않도록 보장하는 검체 채취, 규격 및 시험, 그리고 분석 문서화, 출하 절차와 관련된 GMP 업무 전반을 수행하기 때문에 의약품(제품)의 수가 많은 회사의 경우는 분석 시험의 수와 샘플이 많다(=일이 많다) 라고 이해할 수 있습니다.
제약회사 QC 부서는 많은 업무를 수행하지만, 아래 분류로 나눌 수 있습니다.
1) 검체 분석 (Sample Analysis, IPC(반제품)/출하시험/안정성시험)
- 원료 분석
원료의약품 제조를 시작하기 전에 제조에 사용되는 원료의 순도 및 식별, 적절한 품질 분석을 수행하는 것입니다. 하나의 제품 제조를 위해 사용되는 원료의 수는 20-60개 이상까지 필요할 수 있습니다. 원료 테스트의 범위는 원료 제조회사에서 결정한 항목이 있으며, 최초 원료 회사에서 원료 출하를 위한 CoA(Certificate of Analysis)에 명시된 테스트 항목들이 그것입니다. 일반적인 약전 시험(USP, EP, BP 및 JP)의 방법으로 특성 성분의 순도 시험이나 함량 시험을 진행합니다.
- 제품 분석
공정 중 검체 (In-process Control; IPC), 원료의약품, 완제 의약품 등의 검체를 품질 기준에 맞는지 확인을 위해 분석을 진행합니다.
공정 단계 중 검체, 원료 의약품, 반제품, 완제 의약품 등은 각 단계에서 요구되는 분석 시험이 정의되어 있습니다. 이에 따라 검체 분석 시험이 요청되며, QC 부서는 각 분석 요청에 따라 분석을 진행하고 결과를 보고 합니다.
공정 및 제형에 따른 검사 항목의 예시
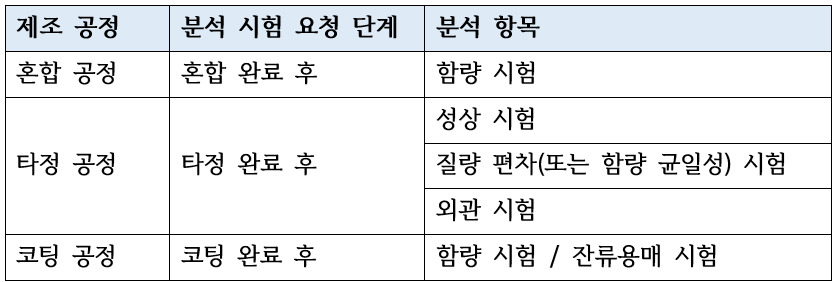
I. 공정 중 검체 (In-process Control; IPC) 시험 – 공정 프로세스 진행 단계 사이에서 각 단계 진행 여부의 결정 및 평가를 위한 IPC 샘플 분석을 진행합니다. 각 제조 공정 중간 적절한 품질 검사를 통해 제품 제조 프로세스의 실패를 사전에 줄이고자 하는 목적도 있습니다. 일부 시험은 제조/생산 부서 작업자가 직접 하는 항목도 있으며 (제조지시서/제조기록서에 해당 분석항목은 기술됩니다), 공식적인 QC 분석 결과 데이터 확인 후 평가 기준에 적합한 것을 평가하고 다음 공정을 진행하게 됩니다.
II. 출하 시험 – “출하” 는 ” 의약품이 최종 제조되고, 판매를 위해 공장에서 유통 사(외부 site) 또는 병원 등으로 출고 되는 것을 의미 합니다. 결국, 최종 제조된 완제의약품의 품질이 품질 기준에 적합한지를 평가하는 매우 중요한 품질 시험 단계입니다. 출하 시험 항목은 의약품 개발 단계에서 품질 평가 기준에 따른 분석 시험법(기준 및 시험방법, 기시법)에서 정해져야 하며, 케미컬 의약품 및 바이오 의약품에서의 출하 시험 항목에 차이가 있습니다. 케미컬 의약품의 경우에도 의약품의 제형 (예: 정체, 캡슐제, 과립제, 산제 등)에 따라 주요 품질 특성 (CQA, Critical Quality Attribute)이 결정됩니다.
III. 안정성 시험 – 안정성 시험은 완제품의 유효기간(shelf-life)와 보관 조건을 결정하기 위한 목적의 분석 시험이며, 안정성 trend 를 평가할 수 있는 분석 시험법을 선정해 제품 3Lot (or batch) 에 대해 계획한 기간 동안 정기적으로 품질 분석을 수행하는 것입니다. 자세한 설명은 6)항 안정성 시험 내용을 확인하시기 바랍니다.
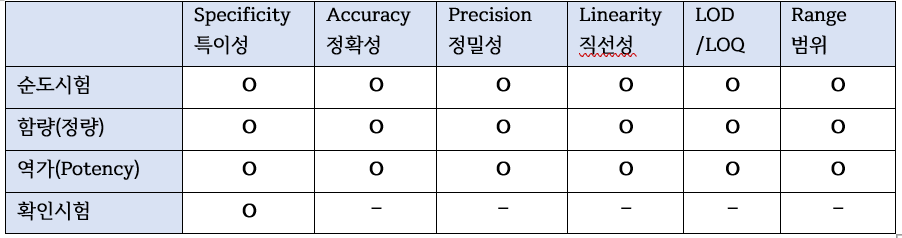
2) 분석법 밸리데이션 (Analytical Method Validation;AMV)
의약품등의 품질관리를 위한 시험방법의 타당성을 미리 검증하고 문서화하는 것입니다.
분석 시험은 제품의 품질 특성을 분석하기 위해 연구소(R&D)에서 분석법 개발 후 QC 로 기술이전 (별도의 절차 및 문서화 과정이 필요합니다) 하거나, 타 회사의 제품을 분석하는 경우에는 해당 회사로부터 직접 QC 로 분석법을 기술이전 받습니다.
QC에서 제품 분석을 위한 분석법을 공식적으로 사용하는 것은 해당 분석법이 실제 제품 분석을 위해 공정성(타당성)을 갖추고 있음을 전제해야 합니다. 예를 들어, 제품의 분석 결과가 기준규격을 벗어난 결과가 확인되었을 때, 이상결과가 제품 품질에서 기인한 것인지, 분석 시험법의 오차 등에서 기인한 것인지 판단을 할 수 없습니다. 따라서, 제품 품질의 정확한 분석과 분석 결과 신뢰를 위해 기본적으로 분석 시험방법은 철저히 “검증” 되어야 하고, 그 방법이 분석 시험법 밸리데이션입니다
3) 환경 모니터링 업무
환경모니터링은 무균 공정을 보증하고, 유지하기 위한 중요한 절차입니다. 특히, 바이오의약품 제조는 무균 상태(청정구역; Clean room)이 유지되는 환경에서 진행되어야 하므로, 환경모니터링의 중요도가 매우 높습니다.
환경모니터링 전에 제조 시설의 설계/건설이 고려되어야 합니다(작업 동선을 최소화하거나, 원료와 작업자 이동 구간의 간섭 등). 제조 현장에서 노출된 모든 표면은 오염 가능성이 존재합니다. 먼지가 쌓이게 되면 미생물 또는 미립자가 축적될 수 있으므로 적절한 소독제/세척제를 통해 청소를 진행해야 합니다
*Clean Room(청정구역)
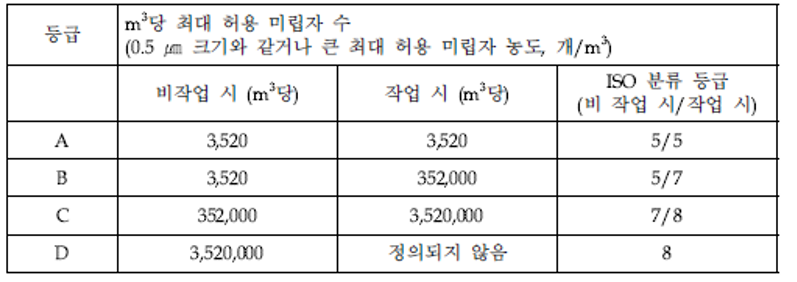
Clean room 은 적절한 성능을 갖는 필터(예: HEPA 필터)를 통해 여과된 공기가 공급되어야 합니다. Clean room의 등급은 ISO 14644-1에 따라 분류되며, m3 당 최대 허용 미립자수에 따라 A, B, C, D 등급이 나뉘며, ISO 분류 등급으로는 5, 7, 8 등급이 있습니다(숫자가 작을 수록 매우 높은 수준의 무균 환경을 요구합니다. Critical 공정은 ISO 5 등급의 Clean room에서 수행됩니다)
등급에 따른 부유입자 최대 허용 미립자 농도
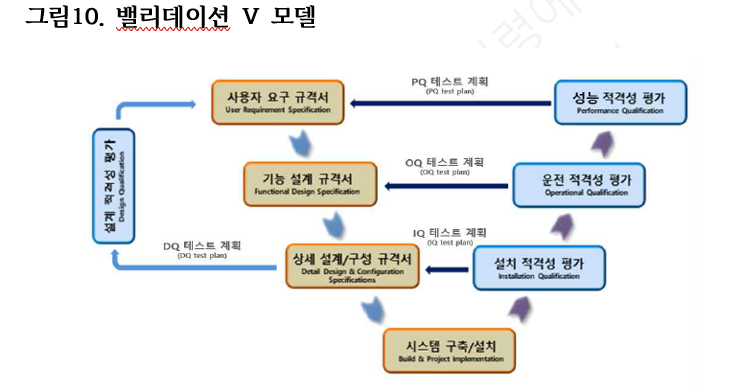
4) 장비 적격성 평가 (Equipment Qualification;EQ)
장비 적격성 평가는 분석 장비가 신규 설치되고, GMP 목적으로 장비를 사용하기 위한 평가를 의미합니다. 장비 사용 전에 장비 운용 시 사용하는 기능들을 검증(밸리데이션) 한다고 이해하시기 바랍니다. 적격성 평가는 아래의 단계를 거칩니다. “V모델” 이라고 하며, 밸리데이션 개념에서 매우 흔하게 사용되니 꼭 이해하고 계시기 바랍니다.
5) 실험실 조사 (Lab. investigation; Laboratory investigation)
- 정의
분석 시험의 결과에서 기대하지 않는 결과(규격 기준 초과) 또는 이상 결과(Peak 사라짐 또는 추가 peak, 추가 밴드 관찰 등) 발생 시, 실험실 내 발생 원인을 조사하는 절차
- 절차
[이상 결과 발견] ▻ [실험실 내 원인 요소 조사] ▻ [이상 결과의 원인 확인을 위한 조사 시험 진행] ▻ [조사 결과에 따른 발생 원인 평가]
분석 시험 중 이상 결과가 발생하면 해당 분석에 사용했던 검체나 표준물질, 이동상 용액 등은 조사가 끝날 때까지 보존해야 합니다. (원인 조사 시 사용될 수 있습니다.) 보통은 분석자가 인지하지 못한 검체 전 처리 과정의 실수나 오류로 인한 경우, 또는 전 처리 과정 중의 오염 발생 등의 가능성이 있습니다.
분석자 및 분석 시험법 과정에 대한 조사를 통해 원인을 밝히지 못한 경우에는 발생 가능한 가설을 동원해 조사 시험을 진행할 수 있습니다. 이때 새로운 검체를 불출 받아 기존 검체와 함께 분석하거나, 이동상을 교차하여 분석해 보는 방법 등을 통해 실제 분석 결과에 이상이 있음을 밝히거나 원인을 찾아낼 수 있습니다.
제약회사 QA 하는 일
제약회사 QA 는 제조와 연관된 전반적 범위에서 역할이 필요한 부서 입니다. 왜냐하면, 제조/생산/물류/구매/포장/공무/품질관리 실무 부서에서 자체 업무를 수행했음을 검증할 방법이 없기 때문입니다. 따라서, QA 부서는 여러 실무 부서를 개별로 상대하기도 하고, 전체적인 정책 적용을 위해 여러 부서를 상대하기도 합니다.
단순히 품질과 관련한 문서만을 검토/승인 하는 것이 아닌, 제품 품질의 시작 – 과정 – 끝의 모든 과정에 관여해 적격한 품질의 제품이 동일한 제조 환경에서 지속적으로 생산/출하될 수 있도록 하는 역할을 하는 부서입니다. 품질 정책 수립부터 품질 업무 전반에 걸쳐 제조 과정 및 제품 최종 출하 보증까지 품질 전반에 영향을 미치는 중요한 부서입니다.
제약회사 QA 부서가 업무를 수행하는 실무 사례들에 대해 정리했습니다.
◾ 공장의 시설과 기기들은 적격한 기준에 따라 도입되고 기능 검증되었는지
◾ 제품 생산에 사용되는 자재들은 적격한 기준에 충족하는지
◾ 제품 생산 준비 상태나 생산 과정에서의 절차 위반 또는 중간 단계 기준, 환경 기준에 문제가 없는지
◾ 제품 품질에 관련한 시험 결과와 시험 환경, 시험 기기 들은 적격하고, 적절히 유지 관리되는지
◾ 시험 방법은 적격한지, 개발된 시험 방법은 문제없이 절차화되었는지
◾ 제품 규격 이탈에 대한 평가와 처리, 사후 보완은 적절히 되었는지
◾ 생산 및 이후 일련의 과정 중에 예기치 않은 사건(문제)은 발생하지 않았는지, 문제 발생은 어떻게 대처하고, 사후 보완 계획을 수립/모니터링할 것인지
◾ 제품의 출하 기준에 적격한지, 출하된 제품의 불만은 없는지
◾ Quality Goverance를 Global 기준에 맞게 수립하고, 정책을 바르게 세웠는지
◾ Quality system에 대한 주기적인 모니터링 및 보고/보완이 되었는지
◾ 허가규제기관(예: 식약처, FDA, EMA)으로 부터의 Inspection/Audit에 대한 준비 및 대응 준비 및 실전 대응이 가능한 지
◾ GMP 정책/절차 등에 대한 적절한 교육 시스템과 교육 이력 관리가 이루어지고 있는지
1) 제조/생산 QA업무
주요 공정 단계의 oversight (감독)을 수행해야 하며, 생산 장비들의 적격성 평가 문서를 검토/승인합니다.
완제의약품을 출하 승인 진행하고, 출하 이후 제품 사용 중 품질 이슈에 대해서는 “불만” 절차를 수행/관리합니다. 회사의 규모에 따라 생산 QA 와 제품 출하 QA는 한 부서가 될 수도 있고, 별도 unit 부서로 관리될 수 있습니다. 신입 채용이 가장 많은 QA 부서이며, 그 이유는 제조 제품 수가 증가하게 되면 관련 업무 (제조지시서, 제조기록서 등 생산 공정 관련 문서 검토/승인) 가 증가하기 때문입니다.
2) QC QA업무
제품 수 또는 생산 규모에 따라 매우 다양한 QC 이슈를 경험할 수 있는 부서입니다. QC 부서에서 작성 및 기록되는 주요 문서들에 대한 검토/승인을 하기 때문에 QC 부서 경력 직원이 내부 부서 이동을 하는 경우가 있습니다. QC QA 부서 직무 수행을 위해서는 주요 QC 부서 절차인 실험실 조사 또는 OOS 등의 이슈 사항의 평가 및 조치 절차 이해가 우선 필요합니다. 추가로, 일탈, 변경관리, CAPA 등의 QMS 절차들이 매우 빈번히 일어나기 때문에 공통적으로 QMS 절차에 대한 이해 또한 준비가 필요합니다.
3) 원자재 QA업무
의약품 생산 계획이 수립되었는데, 원료 물질이 Ready 가 되지 않았다면 생산 일정이 delay 되어 회사입장에서는 그만큼 손실이 발생됩니다. 따라서, 원료/자재의 시기 적절한 Release 가 중요하며, QC 부서에서 원료/자재에 대한 품질 검사를 수행하므로 해당 원료시험에서 발생하는 이슈에 대한 검토/승인을 진행하는 업무와 원료/자재 품질 분석 결과와 Release 기준에 대한 평가 및 Release 승인의 업무를 맡습니다
4) 정책 QA 관련 업무
현업 부서 업무 담당 QA 부서 성격이 아닌 회사 전체의 Quality System을 관리/운영하는 역할을 합니다. 특히, QA의 QA 역할로 내부 감사를 수행할 수도 있으며, 주요 GMP 규정 및 가이드라인의 모니터링을 통해 최신의 규정을 평가하고 적용시키는 역할을 합니다.
5) QMS 업무
▼ 주요 QMS 절차들
1) Change Control (변경관리)
2) Deviation (일탈 보고서)
3) CAPA (시정 및 예방 조치) + CAPA 유효성 평가
4) Complaint (고객 불만 관리)
5) Quality Audit (품질 감사)
6) Risk Management (위험 관리)
위 QMS 업무는 QA 부서는 물론이고, QC/제조부서/물류/공무 부서 등 GMP Scope 내에서 업무를 수행하는 모든 실무 부서에서도 절차를 이해하고 실제로 수행해야 하는 매우 빈번히 발생되는 업무입니다.
본 포스팅은 제약회사 QC QA 직무 취업 준비 E-book 을 일부 참조했습니다.

언급되지 않은 QC, QA 세부 실무 항목과 사례 (Validation/이화학QC 분석법/미생물 QC 분석법/기술이전/기준일탈(OOS)/검체 관리/안정성 시험/표준품관리/데이터완전성(DI))는 별도로 함께 학습하시길 제안 드립니다.
직무 역량을 쌓을 수 있는 2가지 방법
제약회사 QC QA 직무 역량을 쌓는 3가지 방법을 아래 소개하고, 일정이 매년 수시로 바뀌는 점도 고려해 사전에 관심이 있는 분야나 프로그램들은 수시로 일정을 확인/문의해 두는 게 좋습니다.
1) 파트타이머(알바)/계약직(인턴) 지원
재학 중에 파트타이머(알바)를 지원하여 간접 경험을 쌓습니다. 중견 기업에서도 주기적으로 계약 만료된 파트타이머 자리를 채우기 위해 수시로 채용을 진행합니다. 주요 아르바이트 검색 사이트(알바몬, 알바천국)/ 취업 포털(사람인, 잡코리아 등)에서 ‘제약회사 QC 실험보조’, ‘문서관리’ ,’QC 검체 관리’ 로 매일 검색 후 모니터링합니다.
2) 정부 지원 전문가 양성 교육/프로그램 지원
정부 지원 전문 인력 양성 프로그램이 수시로 모집을 진행하고 있습니다. 따라서, 관련 사이트에 주기적으로 모집 공고 여부를 확인해 적극적으로 지원합니다.
1. 바이오 QC 전문가 과정 (https://www.kopo.ac.kr/ctc/index.do)
▼모집공고 페이지https://www.kopo.ac.kr/ctc/board.do?menu=5265&mode=view&post=660452
2. 연구 장비 전문인력양성과정(https://www.kbsi.re.kr/)
▼모집공고 페이지 https://www.kbsi.re.kr/notice01/articles/view/tableid/notice/id/9009
3. 바이오인력양성사업(http://biojobpass.koreabio.org/)
▼모집공고 페이지 http://biojobpass.koreabio.org/board/board.php?bo_table=notice&idx=4
4. K-NIBRT 교육센터(바이오교육) (http://knibrt.com/main/main.php)
▼모집공고 페이지 http://knibrt.com/community/community01.php?admin_mode=read&no=1076&make=&search=&type=&page=2
5. 의약품 생산/품질 직무 과정 (한국보건복지인재원)( https://www.kohi.or.kr/index.do)
▼모집공고 페이지 https://edu.kohi.or.kr/pt/pa/paa/BD_paa0010l.do?actionMain=02&crseClCode=400#n
6. 충북 바이오산학융합원 https://osongbaio.or.kr/sub.php?code=04_info01&mode=view&no=360
7. 국가과학기술인력개발원 https://alpha-campus.kr/explore?number=0&size=12&keyword=%EB%B6%84%EC%84%9D&orderBy=APPLICATION_END_DATE_TIME
8. 장비사관학교 프로그램 https://see.zeus.go.kr/msi/cntntsService.do?menuId=MNU_0000000000000193 무료이나 12개월 프로그램으로 연말 모집 시기를 잘 확인하시기 바랍니다.
9. 국가임상시험지원재단 https://lms.konect.or.kr/web/course/courseList.do?eduCertifiedYn=N&category1=&schEduCategory= CRO, RA 관련 교육을 제공합니다 (무료, 유료 강좌 구분을 확인하세요)
10. 한국 GMP아카데미 (유료) http://www.bvc.co.kr/index.php 품질 직무 관련 온라인 교육을 제공합니다.
11. EMASS (유료) https://emass.co.kr/y4/bbs/board.php?bo_table=edu_sch&mode=m HPLC 실습 교육을 제공합니다.
12. 성균관대 약학대학 의약품규제과학센터 (유료) https://kraps.co.kr/29 의약품 허가 (RA) 교육 프로그램 (유료이며 재직자 수준의 이해가 필요합니다)
13. 제약바이오 QA·QC 전문가 과정 (충북새일본부) http://www.cbwoman.or.kr

